Таблица Удельная теплота. Удельная теплоа плавления. Удельная теплота испарения. удельная теплота сгорания.
Разбор химического элемента
Вольфрам расположен на 74 позиции таблицы Менделеева, а обозначение – латинская «W». В классическом представлении мы видим серебристое твердое вещество с беловатым оттенком. Элемент относится к побочным.
Впервые о вольфраме начали говорить в конце XVI столетия. Невероятно твердый материал называли вольфрамит, что с латыни звучит как «волчья пена». Первая добыча вольфрама в лаборатории произошло в 1781 году под руководством шведа Шееле.
| Физика вольфрама | Химия вольфрама |
|---|---|
| У металла плотность составляет 19.3 грамма на сантиметр кубический. | Большое значение стойкости к коррозии. |
| Низкая магнитная восприимчивость переводит вольфрам в группу парамагнетиков. | Валентность от 2 до 6, с максимальной устойчивостью при значении 3. |
| Твердость вещества по Бринеллю составляет почти 490 килограмм на миллиметр квадратный. | В нормальных условиях инертен, но в процессе «красного каления» начинает медленно окисляться до оксида вольфрама. |
| Удельное сопротивление электричеству при нормальных условиях составляет 70*10^ (-9) Ом*метр. | В ряде напряжений у вольфрама место за водородом. |
| Звуковая скорость внутри вольфрама отожженного типа составляет 4 300 метров в секунду. | Не растворяется в кислотных средах серного и соляного типов, но растворим в пероксидах на основе водорода. |
| При превышении температурной отметки в 1 600 градусов Цельсия, увеличивает пластичность и становится ковким. | Если имеется окисляющее вещество, выступает как реагент. Когда значение в градусах Цельсия повышается до 550, процессы протекают в разы быстрее. |
Чистый вольфрам не встречается. Его кларки имеются в поверхности земной коры в концентрации 0.00014%. Средние значения по содержанию среди различных пород скачут в промежутке 0.1-2.0 граммов на тонну. Классификация элемента по маркировке представлена в таблице ниже.
Нюансы работы с вольфрамовыми электродами ЭВТ-15
| Маркировка | Примесь | Роль примеси |
|---|---|---|
| «ВЧ» | Чистый металл | Примеси нет |
| «ВА» | Внедрение алюминия и кремнещелочи | Увеличение устойчивости формы при высоких температурах. Повышение послеотжигной прочности и увеличение температурного режима первичной рекристаллизации |
| «ВМ» | Кремнещелоч + торий | Повышение рекристализационной структуры и прочности при влиянии высоких температур. |
| «ВТ» | Окись тория | Увеличение эмиссионных качеств |
| «ВИ» | Окись иттрия | Увеличение эмиссионных качеств |
| «ВЛ» | Окись лантана | Увеличение эмиссионных качеств |
| «ВР» | Рений | Повышение уровня пластичности, прочности при влиянии высоких температур, удельного сопротивления и т.э.д.с. |
| «ВРН» | Примеси без присадок | – |
| «МВ» | Молибден | Увеличение параметра стойкости + параллельное увеличение пластичности материала после отжига. |
Наибольшими месторождениями руд вольфрама обладают Канада с Китаем. Небольшие залежи имеются также в России и Корее. В год добывают порядка 60 тысяч тонн тугоплавкого металла. Доля Китая в этом составляет 40%+. Лидерами импорта выступает США, Япония и Германия, а экспортеры – Китай, Южная Корея и Австралия.
О направлениях использования вольфрама расскажет таблица ниже.
| Область применения | Особенности |
|---|---|
| Спецсталь | В данном случае вольфрам является либо ключевым компонентом, либо выступает легирующей добавкой. К специальным сталям с вольфрамными вкраплениями относят быстрорежущие (до 23% W), инструментальные (до 2%), и хромвольфраммарганцевые (до 1.5%). Из спецсталей |
| Сплавы твердого типа | Основа из карбида в связке с вольфрамом – добавка с большими показателями тугоплавкости, прочности + стойкости к износу. Долевое вхождение чистого вольфрама составляет от 85% до 95%. Сплавы твердого типа используются с целью элементов буров компонентов для резки. |
| Сплавы на износ | Здесь на всю используется свойство тугоплавкости вольфрама. Популярными сплавками с устойчивостью к жару являются вариации с вкраплениями хрома или кобальта. Сплав используют как наплавки для поверхностей, что сильно изнашиваются. В частности, автомобильные запчасти. |
| Сплавы «тяжелого» и контактного типа | В категорию относят сплавы, содержащие купрум или аргентум. Материал эффективно себя проявляет в процессе производства компонентов для будильников, электродов на сварку и тому подобного. |
| Освещение | Вольфрамовая проволока – это основа для нитей накаливания, что повсеместно применяются нами в быту. Помимо этого, тонкие прутики из сплава металла применяются как электронагревающий компонент для печей с высоким температурным режимом. Работа оговоренных деталей протекает в вакуумной сфере или других газообразных инертных средах на основе водорода. |
| Электродные составляющие в сварках | «W» – основа для дуговой сварки. Материал выдерживает колоссальные температуры, что позволяет обрабатывать сваркой любой существующий металл. |
В отношении распространенности, вольфрамовые прутки удерживают лидирующие позиции по количеству заготовок. Сырьевой основой для производства прутиков служит штабик. Оговоренные детали служат основой для сварочных работ в быту и промышленности. Недалеко ушла по популярности и вольфрамовая проволока. Далее будут описаны особенности изготовления непосредственно вольфрама + его заготовок.
Источник: http://wikimetall.ru/spravochnik/temperatura-plavlenija-volframa.html
История и происхождение названия
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» – лат. spuma lupi или нем. Wolf Rahm[6][8]. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирал олово как волк овцу»).
В английском и французском языках вольфрам называется tungsten (от швед. tung sten — «тяжёлый камень»). В 1781 году знаменитый шведский химик Карл Шееле, обрабатывая азотной кислотой минерал шеелит, получил жёлтый «тяжёлый камень» (триоксид вольфрама)[источник не указан 3090 дней]. В 1783 году испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита как растворимой в аммиаке жёлтой окиси нового металла, так и самого металла[источник не указан 3090 дней]. При этом один из братьев, Фаусто, был в Швеции в 1781 году и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Источник: http://wiki2.org/ru/Вольфрам
Плотность вольфрама, его теплопроводность, теплоемкость и другие свойства
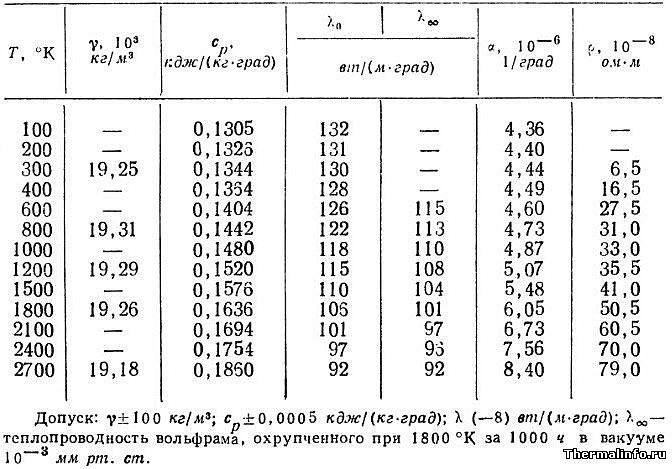
Теплопроводность и другие теплофизические свойства вольфрама W чистотой 99,9% представлены в таблице в интервале температуры от 100 до 2700 К. Даны следующие свойства чистого металлического вольфрама: плотность, удельная массовая теплоемкость, теплопроводность, коэффициент теплового расширения (КТР), удельное электрическое сопротивление.
По данным таблицы видно, что плотность вольфрама при нагревании уменьшается из-за его теплового расширения. Кроме того, при нагревании чистого вольфрама его теплопроводность уменьшается, а массовая теплоемкость увеличивается. Например, удельная теплоемкость вольфрама составляет 134,4 Дж/(кг·К) при комнатной температуре, а при его нагревании до 2100°C, его теплоемкость возрастает до величины 175 Дж/(кг·К).
Источники:
- В. Е. Зиновьев. Теплофизические свойства металлов при высоких температурах.
- Чиркин В. С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.
Источник: http://thermalinfo.ru/svojstva-materialov/metally-i-splavy/teploprovodnost-i-svojstva-volframa
Нахождение в природе
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трёхокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 · mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
Источник: http://wiki2.org/ru/Вольфрам
Структура и характеристики
Кристаллы вольфрама имеют объемноцентрированную кубическую решетку. Основная форма, размеры кристаллов не изменяются, если порошок прессуется при низких температурах.
Атомы в кубической ячейке металла расположены по всем вершинам и внутри самой ячейки. Коэффициент компактности вольфрама — 0,68.
Источник: http://metalloy.ru/metally/volfram
Получение

Вольфрамовый порошок
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Источник: http://wiki2.org/ru/Вольфрам
Почему вольфрам такой тяжелый
Плотность различных элементов отражает размер составляющих их атомов. Чем ниже элемент в периодической таблице, тем крупнее и тяжелее атомы.
Более тяжелые элементы, такие как вольфрам, имеют больше протонов и нейтронов в ядре и больше электронов на орбите вокруг ядра. Это означает, что вес одного атома значительно увеличивается при переходе по таблице Менделеева.
На практике, если вы держите кусок вольфрама в одной руке и такой же объем серебра или железа в другой, вольфрам будет намного тяжелее. В частности, плотность вольфрама составляет 19,3 грамма на кубический сантиметр. Для сравнения, серебро примерно вдвое меньше вольфрама (10,5 г/см3), а железо почти на треть меньше (7,9 г/см3).
Плотность вольфрама может быть преимуществом в определенных областях применения. Его часто используют в бронебойных пулях, например, из-за его плотности и твердости. Военные также используют вольфрам для изготовления так называемого «кинетического бомбардировочного» оружия, которое стреляет из вольфрамового стержня, как воздушный таран, чтобы пробивать стены и броню танка.
Во время холодной войны ВВС США якобы экспериментировали с идеей под названием «Проект Тор», которая должна была сбрасывать связку 6-метровых вольфрамовых стержней с орбиты на вражеские цели. Эти так называемые «стержни от Бога» имели бы разрушительную силу ядерного оружия, но без ядерных осадков. Оказалось, что запуск тяжелых стержней в космос обходился слишком дорого.
Источник: http://novstudent.ru/volfram-i-temperatura-ego-plavleniya-interesnyie-faktyi-o-volframe/
Химические свойства
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот[10]:
2W+4HNO3+10HF⟶WF6+WOF4+4NO↑+7H2O{displaystyle {mathsf {2W+4HNO_{3}+10HFlongrightarrow WF_{6}+WOF_{4}+4NOuparrow +7H_{2}O}}}
Реагирует с расплавленными щелочами в присутствии окислителей[11]:
2W+4NaOH+3O2⟶2Na2WO4+2H2O{displaystyle {mathsf {2W+4NaOH+3O_{2}longrightarrow 2Na_{2}WO_{4}+2H_{2}O}}}
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2[WF6]. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Источник: http://wiki2.org/ru/Вольфрам
Применение
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам

Нить накаливания
- Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах[12] или более эффективной при равном весе[13]. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др.[14] либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе[15].
Соединения вольфрама
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества.Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама[16]
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Источник: http://wiki2.org/ru/Вольфрам
Марки
Марки вольфрама:
- ВР — соединение вольфрама с рением.
- ВТ, ВИ, ВЛ — к основе добавляется присадка окиси лантана, тория, иттрия.
- ВРН — металл без присадок. Допускается наличие небольшого количества разных примесей.
- ВМ — к основе добавляются разные присадки. Основные — кремнещелочные, алюминиевые.
- МВ — соединение молибдена с вольфрамом. Сохраняется пластичность одновременно с повышением прочности.
- ВЧ — чистый металл без примесей, присадок.
- ВА — соединение основы с алюминием, кремнещелочными присадками.
Лампы накаливания не просто так имеют стеклянную герметичную капсулу. Поскольку вольфрам быстро окисляется на открытом воздухе, капсула заполняется инертным газом.

Источник: http://metalloy.ru/metally/volfram
КЛАССИФИКАЦИЯ
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.38.1 |
Источник: http://mineralpro.ru/minerals/tungsten/
Биологическая роль
Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Существуют облигатно-зависимые от вольфрама формы архебактерий-гипертермофилов, обитающие вокруг глубоководных гидротермальных источников. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея — существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни[17].
Пыль вольфрама, как и большинство других видов металлической пыли, раздражает органы дыхания.
Источник: http://wiki2.org/ru/Вольфрам
Интересные факты
Вольфрам — самый тяжёлый материал в инженерии, у него самая высокая точка плавления, самый высокий модуль упругости и самое низкое давление пара. Кроме того, он не окисляется на воздухе и сохраняет прочность при высоких температурах и растяжении. Это один из самых популярных цветных металлов, который не оказывается сильного воздействия на растения, людей или животных. В умеренных количествах он не опасен для здоровья.
Источник: http://obrabotkametalla.info/splavy/xarakteristiki-volframa-gde-ispolzuetsya
Изотопы
Известны изотопы вольфрама с массовыми числами от 158 до 192 (количество протонов 74, нейтронов от 84 до 118), и более 10 ядерных изомеров.[18]
Природный вольфрам состоит из смеси пяти изотопов (180W — 0,12(1)%, 182W — 26,50(16) %, 183W — 14,31(4) %, 184W — 30,64(2) % и 186W — 28,43(19) %)[18]. В 2003 открыта[19] чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180W, имеющего период полураспада 1,8⋅1018 лет[20].
Источник: http://wiki2.org/ru/Вольфрам
Примечания
- ↑ 1 2 3 4 Ракова Н. Н. ВОЛЬФРАМ (рус.). bigenc.ru. Большая российская энциклопедия – электронная версия (2016). Дата обращения: 8 августа 2020.
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 Tungsten: physical properties (англ.). WebElements. Дата обращения: 17 августа 2013.
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — P. 6-134. — 2828 p. — ISBN 1420090844.
- ↑ См. обзор измерений в: Tolias P. (2017), Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications, arΧiv:1703.06302
- ↑ 1 2 3 4 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 418. — 623 с. — 100 000 экз.
- ↑ Теплофизические свойства вольфрама
- ↑ Большая советская энциклопедия Гл. ред. А. М. Прохоров. — 3-е изд. — М. : Сов. энцикл., 1969 – 1978
- ↑ Титан - металл будущего (рус.).
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 347.
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — С. 348.
- ↑ Brian Wheeler. Tungsten Shielding Helps at Fukushima Daiichi (неопр.). Power Engineering Magazine (1 июля 2011).
- ↑ Murata Taisuke, Miwa Kenta, Matsubayashi Fumiyasu, Wagatsuma Kei, Akimoto Kenta, Fujibuchi Toshioh, Miyaji Noriaki, Takiguchi Tomohiro, Sasaki Masayuki, Koizumi Mitsuru. Optimal radiation shielding for beta and bremsstrahlung radiation emitted by 89Sr and 90Y: validation by empirical approach and Monte Carlo simulations // Annals of Nuclear Medicine. — 2014. — 10 мая (т. 28, № 7). — С. 617—622. — ISSN 0914-7187. — doi:10.1007/s12149-014-0853-6. [исправить]
- ↑ Kobayashi S., Hosoda N., Takashima R. Tungsten alloys as radiation protection materials // Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. — 1997. — Май (т. 390, № 3). — С. 426—430. — ISSN 0168-9002. — doi:10.1016/S0168-9002(97)00392-6. [исправить]
- ↑ Soylu H. M., Yurt Lambrecht F., Ersöz O. A. Gamma radiation shielding efficiency of a new lead-free composite material // Journal of Radioanalytical and Nuclear Chemistry. — 2015. — 17 марта (т. 305, № 2). — С. 529—534. — ISSN 0236-5731. — doi:10.1007/s10967-015-4051-3. [исправить]
- ↑ по данным “Цены на вольфрам”
- ↑ Федонкин М. А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь // Палеонтологический журнал. — 2003. — № 6. — С. 33—40
- ↑ 1 2 Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.

- ↑ F. A. Danevich et al. α activity of natural tungsten isotopes (англ.) // Phys. Rev. C : journal. — 2003. — Vol. 67. — P. 014310. — doi:10.1103/PhysRevC.67.014310.
- ↑ C. Cozzini et al. Detection of the natural α decay of tungsten (англ.) // Phys. Rev. C : journal. — 2004. — Vol. 70. — P. 064606. — doi:10.1103/PhysRevC.70.064606.
Источник: http://wiki2.org/ru/Вольфрам